| Обучение и материалы |
|---|
| Физический справочник |
| Формулы по физике |
| Шпаргалки по физике |
| Энциклопедия |
| Репетиторы по физике |
| Работа для физиков |
| Быстрый устный счет |
| Виртуальные лабораторные |
| Опыты по физике |
| ЕГЭ онлайн |
| Онлайн тестирование |
| Ученые физики |
| Необъяснимые явления |
| Ваша реклама на сайте |
| Разное |
| Контакты |
| Спецкурс |
|---|
| Фейнмановские лекции |
|
В мире больших скоростей |
Введение в теорию относительности |
|
Лекции по биофизике |
| Лекции по ядерной физике |
| Ускорение времени... |
| Лазеры |
| Нанотехнологии |
| Книги |
| полезное |
|---|
| Смешные анекдоты о физике
Готовые шпоры по физике Физика в жизни Ученые и деньги Нобелевские лауреаты Фото Видео Карта сайта |
| На заметку |
|---|
| Если вам понравился сайт, предлагаем разместить нашу кнопку |
| Дополнительно |
|---|
|
Компьютерные программы по физике 
Физика и юмор 
Онлайн тестирование по физике 
|
Химические связи в кристаллах
Механические свойства кристаллов несомненно зависят от рода химических связей между атомами. Поражающая неодинаковая прочность слюды по разным направлениям зависит от характера межатомной связи в этих направлениях. Вам наверняка уже рассказывали на лекциях по химии о разных типах химических связей. Прежде всего бывают ионные связи, мы уже говорили о них, когда толковали о хлористом натрии. Грубо говоря, атомы натрия теряют по одному электрону и становятся положительными ионами; атомы хлора приобретают электрон и становятся отрицательными ионами. Положительные и отрицательные ионы располагаются в трехмерном шахматном порядке и удерживаются вместе электрическими силами.
СМОТРИТЕ ТАКЖЕ:Социальные комментарии Cackle |
© All-Физика, 2009-2026
При использовании материалов сайта ссылка на www.all-fizika.com обязательна.
При использовании материалов сайта ссылка на www.all-fizika.com обязательна.

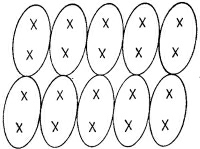 Кристалл сахара обладает другим типом связи. Он состоит из больших молекул, атомы которых сильно связаны ковалентной связью, так что молекула образует прочную структуру. Но так как сильные связи вполне насыщены, то между отдельными молекулами имеется относительно слабое притяжение. В таких молекулярных кристаллах молекулы сохраняют, так сказать, свою индивидуальность, и внутреннее устройство можно изобразить так, как на фиг. 30.3. Поскольку молекулы не очень крепко держатся друг за друга, то кристалл легко можно расколоть. Такого рода кристаллы резко отличаются от кристаллов типа алмаза, который есть не что иное, как одна гигантская молекула, не поддающаяся разлому без того, чтобы не нарушить сильные ковалентные связи.
Кристалл сахара обладает другим типом связи. Он состоит из больших молекул, атомы которых сильно связаны ковалентной связью, так что молекула образует прочную структуру. Но так как сильные связи вполне насыщены, то между отдельными молекулами имеется относительно слабое притяжение. В таких молекулярных кристаллах молекулы сохраняют, так сказать, свою индивидуальность, и внутреннее устройство можно изобразить так, как на фиг. 30.3. Поскольку молекулы не очень крепко держатся друг за друга, то кристалл легко можно расколоть. Такого рода кристаллы резко отличаются от кристаллов типа алмаза, который есть не что иное, как одна гигантская молекула, не поддающаяся разлому без того, чтобы не нарушить сильные ковалентные связи.