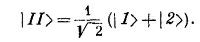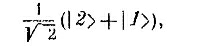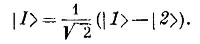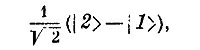Главная >> Фейнмановские лекции по физике >> Том 8 >> Глава 8. Другие системы с двумя состояниями Молекула водорода
В качестве очередной системы с двумя состояниями рассмотрим нейтральную молекулу водорода Н2. В ней, естественно, труднее разобраться, потому что там имеются два электрона. Мы опять начнем с рассуждений о том, это происходит, когда оба протона достаточно удалены друг от друга. Но теперь к ним следует добавить еще два электрона. Чтобы удобнее было следить за ними, назовем их «электрон а» и «электрон b». Здесь опять можно себе вообразить дна мыслимых состояния. Одна возможность: «электрон а» размазан вокруг первого протона, а «электрон b» — вокруг второго (фиг. 8.4). Получаются попросту два атома водорода. Это состояние назовем |/>. Но есть и другая возможность: вокруг первого протона размазан «электрон b», а вокруг второго — «электрон a». Это состояние обозначим |2>. Из-за симметрии эти две возможности обязаны быть энергетически эквивалентными, но, как мы увидим, энергия системы не есть просто энергия двух атомов водорода.
Нужно заметить, что имеются многие другие возможности. Например, «электрон a» может находиться близ первого протона, а «электрон b> — в другом состоянии вокруг того же протона. Мы не станем рассматривать такой случай, поскольку его энергия заведомо будет больше (из-за сильного кулоновского отталкивания между двумя электронами). Для большей точности, конечно, стоило бы учесть и такие состояния; но уже из рассмотрения одной только пары состояний, показанных на фиг. 8.4. мы узнаем самое главное о молекулярной связи. В этом приближении мы можем описать всякое состояние, задав амплитуду <1|φ> быть в состоянии |1> и амплитуду <2 |φ > быть в состоянии |2 >. Иными словами, вектор состояния |φ> может быть записан в виде линейной комбинации
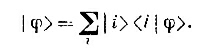 |
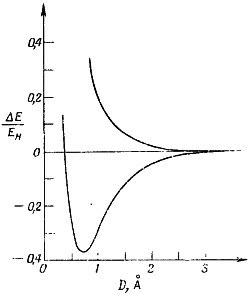 Для дальнейшего, как всегда, предположим, что имеется некоторая амплитуда А того, что электроны могут проходить через промежуточное пространство и обмениваться местами. Эта возможность обмена означает, что энергия системы, как мы наблюдали и в других системах с двумя состояниями, расщеплена. Как и у молекулярного иона водорода, расщепление очень мало, когда расстояние между протонами велико. А когда протоны сближаются, возрастает амплитуда переходов электронов туда-сюда, а вместе с ней растет и расщепление. Убывание энергии в нижнем состоянии означает, что имеется сила притяжения, сближающая атомы. И опять, когда протоны сблизятся особенно тесно, уровни энергии поднимутся вследствие кулоновского отталкивания, В итоге энергии двух стационарных состояний будут меняться с расстоянием так, как показано на фиг. 8.5. На расстоянии порядка 0,74 А низший энергетический уровень достигает минимума; это и есть расстояние между протонами в настоящей молекуле водорода. Для дальнейшего, как всегда, предположим, что имеется некоторая амплитуда А того, что электроны могут проходить через промежуточное пространство и обмениваться местами. Эта возможность обмена означает, что энергия системы, как мы наблюдали и в других системах с двумя состояниями, расщеплена. Как и у молекулярного иона водорода, расщепление очень мало, когда расстояние между протонами велико. А когда протоны сближаются, возрастает амплитуда переходов электронов туда-сюда, а вместе с ней растет и расщепление. Убывание энергии в нижнем состоянии означает, что имеется сила притяжения, сближающая атомы. И опять, когда протоны сблизятся особенно тесно, уровни энергии поднимутся вследствие кулоновского отталкивания, В итоге энергии двух стационарных состояний будут меняться с расстоянием так, как показано на фиг. 8.5. На расстоянии порядка 0,74 А низший энергетический уровень достигает минимума; это и есть расстояние между протонами в настоящей молекуле водорода.
Но у вас уже, вероятно, появилось возражение. А как же быть с тем, что оба электрона — тождественные частицы? Мы их назвали «электрон а» и «электрон b», но на самом-то деле невозможно сказать, кто из них кто. И мы еще говорили в гл. 2, что если за счет обмена электронами (ферми-частицами) имеются два пути, по которым что-то может произойти, то две амплитуды будут интерферировать с отрицательным знаком. Это значит, что если у электронов переставить обозначающие их номера, то знак амплитуды должен перемениться. Однако мы только что пришли к выводу, что связанное состояние молекулы водорода имело бы вид (при t=0)
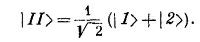 |
А согласно нашим правилам, перечисленным в гл. 2, такое состояние недопустимо. Если переставить номера электронов, то мы получим состояние
и знак выйдет тот же, а не обратный.
Эти рассуждения верны, но только тогда, когда спины обоих электронов одинаковы. Если у них обоих спины смотрят вверх (или вниз), то единственно допустимое состояние таково:
Для этого состояния перестановка электронов дает
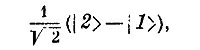 |
что, как и положено, равно — | I>. Значит, если сблизить два атома водорода так, чтобы их электроны вращались глядя в одну сторону, то они смогут перейти лишь в состояние | />, но не в состояние | //>. Но заметьте теперь, что состояние /> — это верхнее энергетическое состояние. Его кривая «энергия — расстояние»не имеет минимума. Два атома водорода всегда будут отталкиваться и не смогут образовать молекулу. Мы заключаем, что молекула водорода, в которой спины электронов параллельны, не способна существовать. И это на самом деле так.
С другой стороны, наше состояние | //> полностью симметрично по двум электронам. Действительно, если переименовать электроны, назвав первый а, а второй b, то мы снова получим в точности то же состояние. В гл. 2, § 1, мы видели, что если две ферми-частицы находятся в одном и том же состоянии, то спины их обязаны быть противоположными. Значит, у связанной молекулы водорода спин одного из электронов должен быть направлен вверх, а спин другого — вниз.
Весь рассказ о молекуле водорода на самом деле будет звучать еще более запутанно, если мы захотим включить в него спины протонов. Тогда уже будет нельзя считать молекулу системой с двумя состояниями. Она скорее должна походить на систему с восемью состояниям, — для каждого из наших состояний |1> и | 2> возможны четыре различные расстановки спинов, так что, прнебрегая спинами, мы слегка упростили дело. Наши окончательные выводы, однако, все равно верны.
Мы нашли, что в низшем энергетическом состоянии молекулы Н2 —единственном связанном состоянии - спины двух эдектронов противоположны друг другу. Полный спиновыи момент количества движения электронов равен нулю. Наоборот, два близких атома водорода с параллельными спинами (и, стало быть, с полным моментом количества движения h) должны находиться в высшем (несвязанном) энергетическом состоянии; атомы будут отталкиваться, Налицо интересная корреляция между спинами и энергиями. Она еще раз иллюстрирует то, о чем мы упоминали раньше: что выходит, будто у двух спинов существует энергия «взаимодействия», потому что случай параллельных спинов обладает большей энергией, чем случай спинов антипараллельных. В каком-то смысле можно говорить, что спины стремятся выстроиться в антипараллельное положение и, стремясь к этому, обладают потенциалом к высвобождению энергии не из-за того, что там имеется большая магнитная сила, а из-за принципа запрета.
В § 1 мы видели, что связь двух различных ионов посредством одного электрона чаще всего оказывается весьма слабой. При двухэлектронной связи это не так. Представим, что два протона на фиг. 8.4 мы заменили любой парой ионов (с замкнутыми внутренними электронными оболочками и единичным ионным зарядом) и что энергии связи электрона в этих двух ионах различны. Энергии состояний |1> и | I2> по-прежнему будут равны друг другу, потому что в каждом из этих состояний имеется по одному электрону на каждый ион. Поэтому у нас всегда будет расщепление, пропорциональное А. Двухэлектронная связь поистине вездесуща — это самая обычная валентная связь. Химическая связь, как правило, предполагает эту игру в «туда-сюда», в которую играют два электрона. Хотя пара атомов может быть связана только одним электроном, это случается сравнительно редко, потому что требует надлежащих условий.
Наконец, надо заметить, что если энергия притяжения электрона к одному ядру намного больше, чем к другому, то уже нельзя говорить, будто можно игнорировать другие мыслимые состояния. Пусть ядро а (это может быть и положительный ион) притягивает электрон намного сильнее, чем ядро b. Это сильное притяжение может более чем компенсировать взаимное отталкивание двух электронов. И если это так, то низшее энергетическое состояние может обладать большой амплитудой того, что оба электрона окажутся возле а (образуя отрицательный ион), и малой амплитудой того, что хотя бы один из них обнаружится возле b. Состояние выглядит как отрицательный ион рядом с положительным ионом. Именно это и случается в «ионных» молекулах наподобие NaCl. Вы видите, что мыслимы любые градации между ковалентной связью и ионной связью.
Теперь вы ясно видите, что многие химические факты на квантовомехаинческом языке удается очень отчетливо понять.
СМОТРИТЕ ТАКЖЕ:
Социальные комментарии Cackle
|




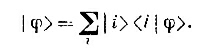
 Для дальнейшего, как всегда, предположим, что имеется некоторая амплитуда А того, что электроны могут проходить через промежуточное пространство и обмениваться местами. Эта возможность обмена означает, что энергия системы, как мы наблюдали и в других системах с двумя состояниями, расщеплена. Как и у молекулярного иона водорода, расщепление очень мало, когда расстояние между протонами велико. А когда протоны сближаются, возрастает амплитуда переходов электронов туда-сюда, а вместе с ней растет и расщепление. Убывание энергии в нижнем состоянии означает, что имеется сила притяжения, сближающая атомы. И опять, когда протоны сблизятся особенно тесно, уровни энергии поднимутся вследствие кулоновского отталкивания, В итоге энергии двух стационарных состояний будут меняться с расстоянием так, как показано на фиг. 8.5. На расстоянии порядка 0,74 А низший энергетический уровень достигает минимума; это и есть расстояние между протонами в настоящей молекуле водорода.
Для дальнейшего, как всегда, предположим, что имеется некоторая амплитуда А того, что электроны могут проходить через промежуточное пространство и обмениваться местами. Эта возможность обмена означает, что энергия системы, как мы наблюдали и в других системах с двумя состояниями, расщеплена. Как и у молекулярного иона водорода, расщепление очень мало, когда расстояние между протонами велико. А когда протоны сближаются, возрастает амплитуда переходов электронов туда-сюда, а вместе с ней растет и расщепление. Убывание энергии в нижнем состоянии означает, что имеется сила притяжения, сближающая атомы. И опять, когда протоны сблизятся особенно тесно, уровни энергии поднимутся вследствие кулоновского отталкивания, В итоге энергии двух стационарных состояний будут меняться с расстоянием так, как показано на фиг. 8.5. На расстоянии порядка 0,74 А низший энергетический уровень достигает минимума; это и есть расстояние между протонами в настоящей молекуле водорода.